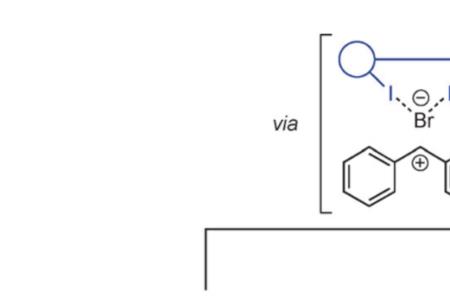
碳卤键极性按F、Cl、Br、I顺序递减。
由于氟原子的电负性最大,所以C-F的极性最强,其偶极矩之所以小于C-C键,是因为前者键长较短。在通常情况下,碳原子与卤素相连后,所带的正电荷密度大小取决于卤素原子的电负性大小,也就是说,C-F键的极性最大,其碳原子理应最容易受到富电子亲核试剂的进攻而发生取代反应。然而实际上,卤代烃与亲核试剂的反应活性大小顺序通常为:
RF<RCl<RB<Rl。这说明决定碳卤键的反应活性大小的主要因素不是键的极性大小,而是键的离解能大小。
原创 | 2022-12-05 20:04:39 |浏览:1.6万
碳卤键极性按F、Cl、Br、I顺序递减。
由于氟原子的电负性最大,所以C-F的极性最强,其偶极矩之所以小于C-C键,是因为前者键长较短。在通常情况下,碳原子与卤素相连后,所带的正电荷密度大小取决于卤素原子的电负性大小,也就是说,C-F键的极性最大,其碳原子理应最容易受到富电子亲核试剂的进攻而发生取代反应。然而实际上,卤代烃与亲核试剂的反应活性大小顺序通常为:
RF<RCl<RB<Rl。这说明决定碳卤键的反应活性大小的主要因素不是键的极性大小,而是键的离解能大小。




Copyright 2005-2020 www.kxting.com 版权所有 |  湘ICP备2023022655号
湘ICP备2023022655号
声明: 本站所有内容均只可用于学习参考,信息与图片素材来源于互联网,如内容侵权与违规,请与本站联系,将在三个工作日内处理,联系邮箱:47085,1089@qq.com