配制浓硫酸体积的公式:c1*V1=c2*V2
一、用液体试剂配制:
根据稀释前后溶质质量相等原理得公式:
ω1ρ1 V1= ω2ρ2 V2
ω1:稀释质量分数ρ1 :密度V1:欲配溶液体积
ω2:浓溶液质量分数ρ2:密度V2:需用浓溶液体积
二、物质的量浓度溶液的配制
1、根据稀释前后溶质的量相等原则得公式:
C1V1=C2V2
C1: 稀释前的浓度 V1:稀释前体积
C2:稀释后的浓度 V2:稀释后体积
2、用固体试剂配制
公式:m=C×V×M/1000
m:需称取的质量 C:欲配溶液浓度
V:欲配溶液体积 M:摩尔质量
3、用液体试剂配制
公式:V1×d×a%=C×V2×M/1000
V1:原溶液体积 V2:欲配置溶液体积
d:比重 a:原溶液百分浓度
c:物质的量浓度 M:相对分子质量
配制浓硫酸体积的公式是什么
浓硫酸物质的量浓度=
1000
ρ
ω
M
=
1000
×
1、84
×
98
98
mol/L=18.4mol/L,配制1mol/L的稀硫酸100mL所需浓硫酸体积=
1
m
o
l
/
L
×
0.1
L
18、4
m
o
l
/
L
=5.4mL,应该选取10mL量筒
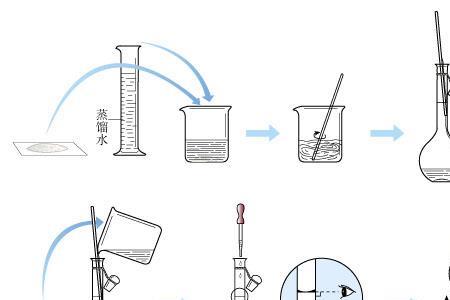
用浓硫酸配制一定物质的量浓度稀硫酸时,其操作步骤是:计算、量取、稀释、冷却、转移、定容、摇匀,量取浓硫酸需要10mL量筒和胶头滴管、量取浓硫酸后倒入50mL烧杯中,稀释浓硫酸用玻璃棒搅拌,转移溶液时用玻璃棒引流,转移的溶液倒入100mL容量瓶中,定容时用胶头滴管