SP2
先计算碳原子的价层电子对,对于任意一个碳原子来说。
½(4-2×1-1×2)+3=3
“2×1”表示另外有两个电子被一个碳原子接收。
“1×2”表示有一个电子被一个氢原子接收,并且有两个氢原子
也就是说,任意一个碳原子只有三对价层电子对,并且无孤对电子。
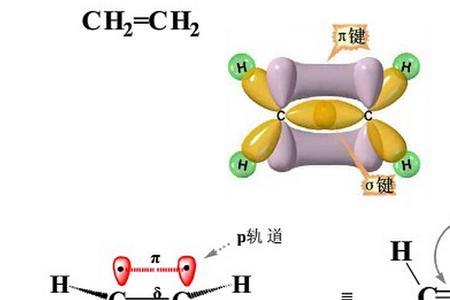
所以乙烯中碳原子轨道杂化形式为sp²杂化
乙烯含有两个碳原子和四个氢原子,就碳原子而言,涉及其最外层的四条轨道,其中S轨道和两条P轨道SP2杂化后形成在同一平面内的三条SP2轨道,剩下的那条P轨道垂直于此平面而氢原子就只有一条S轨道
乙烯原子杂化轨道怎么算
sp2杂化轨道的电子云形状与sp3杂化轨道相似.但sp2 杂化轨道是3个,它们处在同一平面上,并指向正三角形的3个顶点,夹角为120°.这个角度是由量子化学推算出来的. 在乙烯分子中,由于碳原子的3个sp2杂化轨道跟不同的原子(C或H)成键.因此,键角就不完全相等,根据实验测定,乙烯分子的H—C—H键角是116°,而 2个C-C-H键角是122°. 乙烯分子中,构成π键的电子就称为π电子,π键的电子云呈块状,分布在σ键对称轴所在平面的上下,上述平面为π键的对称面.